V zgodnjih jutranjih urah 29. decembra je NEJM na spletu objavil novo klinično študijo faze III o novem kitajskem koronavirusu VV116. Rezultati so pokazali, da VV116 ni bil nič slabši od Paxlovida (nematovir/ritonavir) glede trajanja kliničnega okrevanja in je imel manj neželenih učinkov.
Vir slike: NEJM
Mediana časa okrevanja 4 dni, stopnja neželenih učinkov 67,4 %
VV116 je peroralno nukleozidno zdravilo proti novemu koronavirusu (SARS-CoV-2), razvito v sodelovanju z Junsitom in Wang Shanom Wang Shuijem, in je zaviralec RdRp skupaj z remdesivirjem podjetja Gilead, molnupiravirjem podjetja Merck Sharp & Dohme in azelvudinom podjetja Real Biologics.
Leta 2021 je bila v Uzbekistanu zaključena druga faza kliničnega preskušanja zdravila VV116. Rezultati študije so pokazali, da je skupina, ki je prejemala zdravilo VV116, v primerjavi s kontrolno skupino lahko bolje izboljšala klinične simptome in znatno zmanjšala tveganje za napredovanje bolezni v kritično obliko in smrt. Na podlagi pozitivnih rezultatov tega preskušanja je bilo zdravilo VV116 v Uzbekistanu odobreno za zdravljenje bolnikov z zmerno do hudo obliko COVID-19 in je postalo prvo novo peroralno zdravilo za koronarne bolezni, odobreno za trženje v tujini na Kitajskem [1].
To klinično preskušanje faze III[2] (NCT05341609), ki so ga vodili prof. Zhao Ren iz bolnišnice Shanghai Ruijin, prof. Gaoyuan iz bolnišnice Shanghai Renji in akademik Ning Guang iz bolnišnice Shanghai Ruijin, je bilo zaključeno med izbruhom, ki ga je povzročila varianta Omicron (B.1.1.529), od marca do maja v Šanghaju, z namenom oceniti učinkovitost in varnost zdravila VV116 v primerjavi z zdravilom Paxlovid za zgodnje zdravljenje bolnikov z blagim do zmernim COVID-19. Cilj je bil oceniti učinkovitost in varnost zdravila VV116 v primerjavi z zdravilom Paxlovid za zgodnje zdravljenje bolnikov z blagim do zmernim COVID-19.
Vir slike: Referenca 2
Med 4. aprilom in 2. majem 2022 je bila izvedena multicentrična, za opazovalca slepa, randomizirana, kontrolirana študija z 822 odraslimi bolniki s covidom-19 z visokim tveganjem za napredovanje bolezni in blagimi do zmernimi simptomi, da bi ocenili upravičenost udeležencev iz sedmih bolnišnic v Šanghaju na Kitajskem. Na koncu je 771 udeležencev prejelo bodisi VV116 (384, 600 mg vsakih 12 ur 1. dan in 300 mg vsakih 12 ur od 2. do 5. dne) bodisi Paxovid (387, 300 mg nimatuvirja + 100 mg ritonavirja vsakih 12 ur 5 dni) kot peroralno zdravilo.
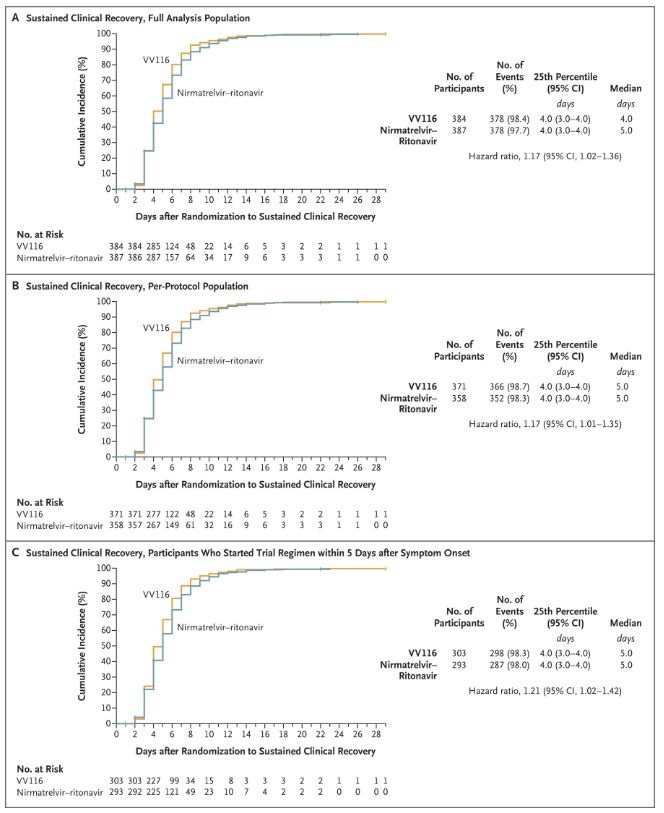
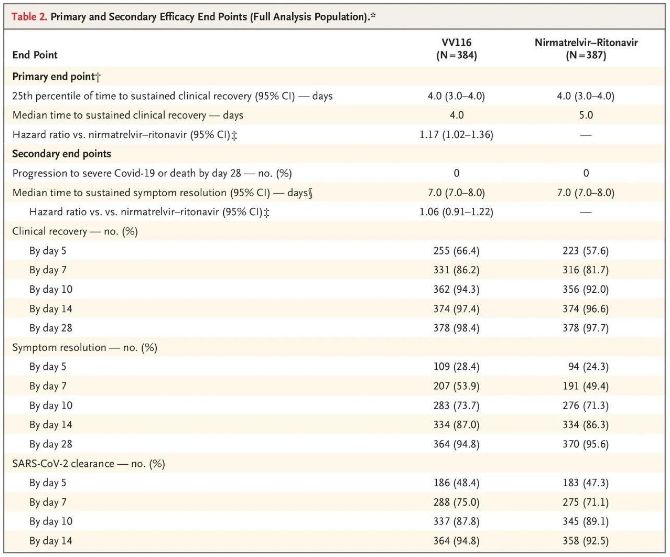
Rezultati te klinične študije so pokazali, da je zgodnje zdravljenje z VV116 za blago do zmerno obliko COVID-19 doseglo primarni cilj (čas do trajnega kliničnega okrevanja), ki ga predvideva klinični protokol: mediana časa do kliničnega okrevanja je bila 4 dni v skupini VV116 in 5 dni v skupini Paxlovid (razmerje tveganja 1,17; 95-odstotni IZ 1,02 do 1,36; spodnja meja > 0,8).
Ohranjanje časa kliničnega okrevanja
Primarni in sekundarni opazovani dogodki učinkovitosti (celovita analiza populacije)
Vir slike: Referenca 2
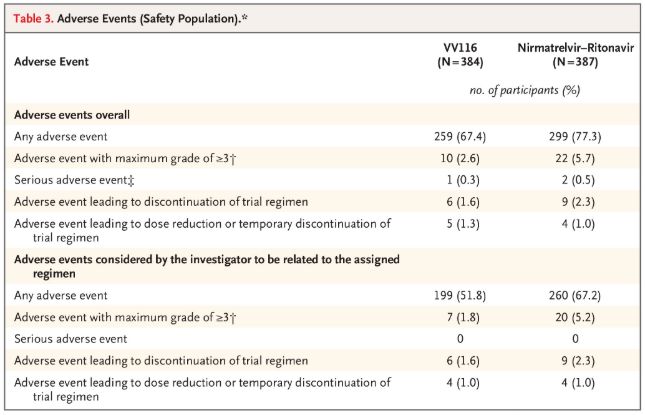
Kar zadeva varnost, so udeleženci, ki so prejemali zdravilo VV116, poročali o manj neželenih učinkih (67,4 %) kot tisti, ki so prejemali zdravilo Paxlovid (77,3 %), pri 28-dnevnem spremljanju pa je bila incidenca neželenih učinkov 3./4. stopnje nižja pri zdravilu VV116 (2,6 %) kot pri zdravilu Paxlovid (5,7 %).
Neželeni dogodki (varne osebe)
Vir slike: Referenca 2
Polemike in vprašanja
Juniper je 23. maja 2022 razkril, da je klinična študija faze III registracije zdravila VV116 v primerjavi z zdravilom PAXLOVID za zgodnje zdravljenje blage do zmerne oblike COVID-19 (NCT05341609) dosegla svoj primarni končni cilj.
Vir slike: Referenca 1
V času, ko podrobnosti o preskušanju niso bile znane, je bila polemika okoli študije tretje faze dvojna: prvič, šlo je za enojno slepo študijo in ker ni bilo kontrolne skupine s placebom, se je balo, da bo zdravilo težko popolnoma objektivno oceniti; drugič, pojavljala so se vprašanja o kliničnih končnih točkah.
Klinična merila za vključitev v študijo za zdravilo Juniper so (i) pozitivni rezultati novega testa krone, (ii) eden ali več blagih ali zmernih simptomov COVID-19 in (iii) bolniki z visokim tveganjem za hud potek COVID-19, vključno s smrtjo. Vendar pa je edini primarni klinični cilj „čas do trajnega kliničnega okrevanja“.
Tik pred objavo, 14. maja, je Juniper revidiral klinične končne točke tako, da je odstranil eno od primarnih kliničnih končnih točk, »delež konverzij v resno bolezen ali smrt« [3].
Vir slike: Referenca 1
Ti dve glavni sporni točki sta bili v objavljeni študiji prav tako posebej obravnavani.
Zaradi nenadnega izbruha zdravila Omicron proizvodnja placebo tablet za Paxlovid pred začetkom preskušanja še ni bila končana, zato raziskovalci niso mogli izvesti tega preskušanja z dvojno slepo, dvojno simulirano zasnovo. Kar zadeva enojno slepi vidik kliničnega preskušanja, je Juniper povedal, da je bil protokol izveden po komunikaciji z regulativnimi organi in da enojno slepa zasnova pomeni, da niti raziskovalec (vključno z ocenjevalcem končne točke študije) niti sponzor ne bosta poznala specifične terapevtske dodelitve zdravil, dokler končna baza podatkov ni zaklenjena na koncu študije.
Do končne analize pri nobenem od udeležencev preskušanja ni bilo smrti ali napredovanja bolezni v hudo obliko Covid-19, zato ni mogoče sklepati o učinkovitosti zdravila VV116 pri preprečevanju napredovanja bolezni v hudo ali kritično obliko Covid-19 ali smrt. Podatki so pokazali, da je bil ocenjeni mediani čas od randomizacije do trajne regresije ciljnih simptomov, povezanih s Covid-19, 7 dni (95 % IZ, 7 do 8) v obeh skupinah (razmerje tveganja, 1,06; 95 % IZ, 0,91 do 1,22) [2]. Ni težko pojasniti, zakaj je bil primarni opazovani dogodek „stopnja prehoda v hudo bolezen ali smrt“, ki je bil prvotno določen pred koncem preskušanja, odstranjen.
Revija Emerging Microbes & Infections je 18. maja 2022 objavila rezultate prvega kliničnega preskušanja VV116 pri bolnikih, okuženih z varianto Omicron [4], odprte, prospektivne kohortne študije s 136 potrjenimi hospitaliziranimi bolniki.
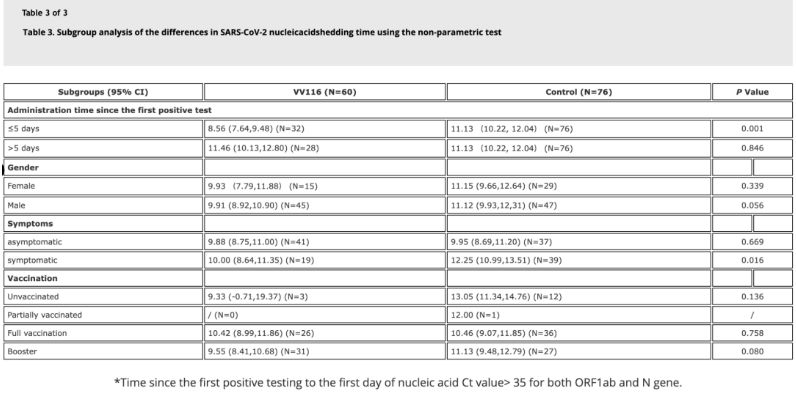
Podatki iz študije so pokazali, da so imeli bolniki z okužbo z zdravilom Omicron, ki so uporabili zdravilo VV116 v 5 dneh po prvem pozitivnem testu nukleinske kisline, čas do regresije nukleinske kisline 8,56 dni, kar je manj kot 11,13 dni v kontrolni skupini. Uporaba zdravila VV116 simptomatskim bolnikom v časovnem okviru te študije (2–10 dni po prvem pozitivnem testu nukleinske kisline) je skrajšala čas do regresije nukleinske kisline pri vseh bolnikih. Kar zadeva varnost zdravila, v skupini, ki je prejemala zdravilo VV116, niso opazili resnih neželenih učinkov.
Vir slike: Referenca 4
Trenutno potekajo tri klinične študije zdravila VV116, od katerih sta dve študiji faze III pri blagi do zmerni obliki COVID-19 (NCT05242042, NCT05582629). Druga študija za zmerno do hudo obliko COVID-19 je mednarodna multicentrična, randomizirana, dvojno slepa klinična študija faze III (NCT05279235) za oceno učinkovitosti in varnosti zdravila VV116 v primerjavi s standardnim zdravljenjem. Glede na objavo podjetja Juniper je bil prvi pacient vključen in prejel odmerek marca 2022.
Vir slike: clinicaltrials.gov
Reference:
[1]Junshi Biotech: Objava o glavni končni točki registrirane klinične študije faze III, v kateri se VV116 primerja z zdravilom PAXLOVID za zgodnje zdravljenje blage do zmerne oblike COVID-19
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai, Yi Zhang, Jianming Zheng, Xiaogang Gao, Junming Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Profil okužb z omikronom in status cepljenja med 1881 prejemniki presajenih jeter: večcentrična retrospektivna kohorta. Emerging Microbes & Infections 11:1, strani 2636-2644.
Čas objave: 6. januar 2023
 中文网站
中文网站